miércoles, 24 de julio de 2013
domingo, 7 de julio de 2013
UNIDADES QUIMICAS...
UNIDADES QUIMICAS DE
CONCENTRACION
Para expresar la concentración de las soluciones se usan también
sistemas con unidades químicas, como son:
a) Fracción
molar
b) Molaridad M =
(número de moles de soluto) / (1 litro de solución)
c) Molalidad m =
(número de moles de soluto) / (1 kilo de solvente)
A) FRACCION MOLAR (Xi): Se define como
la relación entre los moles de un componente (ya sea solvente o soluto) de la
solución y los moles totales presentes en la solución.
EJEMPLO:
Se agregan 3 gramos de sal en una cacerola con 4 litros de agua
¿cuál es la concentración de sal?, o dicho de otra forma ¿cuál es la
concentración de la solución?
Calcular la fracción molar de solvente y de soluto: Recordemos que
la fracción molar expresa la concentración de una solución en Moles de Soluto o
de Solvente por Moles Totales de la Solución.
Solvente: agua (H2O)
Soluto: sal (NaCl)
Datos que conocemos: 3 gramos de soluto y 4.000 cm3 (4
litros) de solvente.
Con estos datos debemos resolver el problema, calculando 4 valores
significativos: moles de solvente, moles de soluto, fracción molar de
solvente y fracción molar de soluto.
Para el agua, se conoce su masa molar = M(H2O) = 18
g/mol (1 mol de H2O contiene 18 g, formados por 2 g de H y 16 g de
O).
Averiguar cuántos moles de solvente H2O) tenemos:
Para la sal (NaCl) su masa molar = M(NaCl) = 58,5 g/mol (1 mol de
sal equivale a 58,5 g, formados por 23 g de Na y 35,5 g de Cl)
Averiguar cuántos moles de soluto tenemos:
Ahora que conocemos la cantidad de moles de solvente y la cantidad
de moles de soluto, podemos calcular las fracciones molares de solvente y de
soluto:
Fracción molar del solvente = Xsolvente
Fracción molar del solvente (agua) = 0,99977
Fracción molar del soluto= Xsoluto
Fracción molar del soluto= 0,00023
Pero sabemos que:
Entonces: 0,99977 + 0,00023 = 1
B) MOLARIDAD (M): Es el número de
moles de soluto contenido en un litro de solución. Una solución 4 molar
(4 M) es aquella que contiene cuatro moles de soluto por litro de solución.
EJEMPLO:
¿Cuál será la molaridad de una solución que
contiene 64 g de Metanol (masa molar del metanol 32 gr/mol) en 500 ml de
solución?
Datos conocidos: metanol 64 g
Masa molar del metanol: 32 g/mol
Masa de la solución: 500 ml (0,5 litro)
Primero calculamos la cantidad de moles que hay en 64 g de
metanol.
Si un mol de metanol equivale a 32 g, 64 g equivalen a 2
moles (64/32=2)
Aplicamos la fórmula:
Respuesta: 4 molar.
C) MOLALIDAD:
En primer lugar debemos advertir que molalidad no
es lo mismo que molaridad por lo cual debemos evitar confundirlas
puesto que el nombre es muy parecido pero en realidad cambian mucho los
cálculos, y es un grave error pero muy frecuente.
En la molalidad relacionamos la molaridad
del soluto con el que estamos trabajando con la masa del
disolvente (en kg) que utilizamos.
La definición de molalidad es la siguiente:
Relación entre el número de moles de soluto por kilogramos de
disolvente (m)
UNIDADES FISICAS...
UNIDADES
FISICAS DE CONCENTRACION
Las unidades físicas de concentración están expresadas en función
del peso y del volumen, en forma porcentual,
y son las siguientes:
a) Tanto por
ciento peso/peso %P/P = (cantidad de gramos de soluto) / (100
gramos de solución)
b) Tanto por
ciento volumen/volumen %V/V = (cantidad de cc de soluto) /
(100 cc de solución)
c) Tanto por
ciento peso/volumen % P/V =(cantidad de gr de soluto)/ (100 cc
de solución)
A) PORCENTAJE PESO A PESO (% P/P): Indica el peso de soluto por cada 100 unidades
de peso de la solución.
B) PORCENTAJE VOLUMEN A VOLUMEN (% V/V): Se
refiere al volumen de soluto por cada 100 unidades de volumen de la solución.
C) PORCENTAJE PESO A VOLUMEN (% P/V): Indica el
número de gramos de soluto que hay en cada 100 ml de solución.
EJEMPLO:
Se tiene un litro de solución al 37%. ¿Cuántos litros de agua se
tienen que agregar para que quede al 4%?
Resolvamos:
El problema no indica las unidades físicas de
concentración. Se supondrá que están expresadas en % P/V.
Datos que conocemos: V = volumen, C= concentración
V1 = 1 litro
C1 = 37%
37% P/V = significa que hay 37 gramos
de soluto en 100 ml de solución (solución = soluto + solvente).
C2 = 4%
V2 = ¿?
REGLA PARA CALCULAR DISOLUCIONES O CONCENTRACIONES:
V1 • C1 =
V2 • C2
Puede expresarse en: % P/V
Reemplazando los datos que se tienen del problema, se
obtiene:
Entonces, si tenemos un litro de solución al 37%; para obtener una
solución al 4% es necesario tener un volumen de 9,25 litros; por lo tanto, para
saber cuantos litros de agua hay que agregar al litro inicial,
hacemos:
V2 –
V1 = Volumen de agua agregado
9,25 –
1 = 8,25 litros
Respuesta: Se deben agregar 8,25 litros de
agua
miércoles, 3 de julio de 2013
SOLUCIONES
SOLUCIONES
Una solución (o disolución) es una mezcla de dos o más componentes,
perfectamente homogénea ya que cada componente se mezcla íntimamente con el
otro, de modo tal que pierden sus características individuales. Esto último
significa que los constituyentes son indistinguibles y el conjunto se presenta
en una sola fase (sólida, líquida o gas) bien definida.
Una solución que contiene agua como solvente se llama solución
acuosa.
Si se analiza una muestra de alguna solución puede apreciarse que en
cualquier parte de ella su composición es constante. Entonces, reiterando,
llamaremos solución o disolución a las mezclas homogéneas
que se encuentran en fase líquida. Es decir, las mezclas
homogéneas que se presentan en fase sólida, como las aleaciones (acero,
bronce, latón) o las que se hallan en fase gaseosa (aire, humo, etc.) no se les
conoce como disoluciones.
Las mezclas de gases, tales como la atmósfera, a veces también se
consideran como soluciones.
Las soluciones son distintas de los coloides y de
las suspensiones en que las partículas del soluto son de
tamaño molecular y están dispersas uniformemente entre las moléculas del
solvente.
Las sales, los ácidos, y las bases se ionizan cuando se disuelven en el
agua.
CARACTERISTICAS DE LAS SOLUCIONES (O DISOLUCIONES):
1. Sus componente no pueden
separarse por métodos físicos simples como decantación, filtración,
centrifugación, etc.
2. Sus componentes sólo
pueden separase por destilación, cristalización, cromatografía.
3. Sus componentes sólo
pueden separase por destilación, cristalización, cromatografía.
- SOLUTO: Es aquel componente que se
encuentra en menor cantidad y es el que se disuelve. El soluto puede
ser sólido, líquido o gas, como ocurre en las bebidas gaseosas, donde el
dióxido de carbono se utiliza como gasificante de las bebidas. El azúcar
se puede utilizar como un soluto disuelto en líquidos (agua).
- SOLVENTE: Es aquel componente que se encuentra en mayor cantidad y es el medio que disuelve al soluto. El solvente es aquella fase en que se encuentra la solución. Aunque un solvente puede ser un gas, líquido o sólido, el solvente más común es el agua.
4. En una disolución, tanto
el soluto como el solvente interactúan a nivel de sus
componentes más pequeños
(moléculas, iones). Esto explica el carácter homogéneo de
las soluciones y la imposibilidad de
separar sus componentes por métodos mecánicos.
MAYOR O MENOR CONCENTRACION
Ya dijimos que las disoluciones son mezclas de dos o más sustancias, por lo
tanto se pueden mezclar agregando distintas cantidades: Para saber exactamente
la cantidad de soluto y de solvente de una disolución se
utiliza una magnitud denominada concentración.
Dependiendo de su concentración, las disoluciones se clasifican en
diluidas, concentradas, saturadas, sobresaturadas.
- DILUIDAS: Si la cantidad de
soluto respecto del solvente es pequeña.
Ejemplo: una solución de 1 gramo
de sal de mesa en 100 gramos de agua.
- CONCENTRADAS: Si la proporción de soluto con
respecto del solvente es grande. Ejemplo: una disolución de 25
gramos de sal de mesa en 100 gramos de agua.
- SATURADAS: Se dice que una disolución está
saturada a una determinada temperatura cuando no admite más cantidad de
soluto disuelto. Ejemplo: 36 gramos de sal de mesa en 100 gramos de
agua a 20º C. Si intentamos disolver 38 gramos de sal en 100 gramos
de agua, sólo se disolvería 36 gramos y los 2 gramos restantes permanecerán
en el fondo del vaso sin disolverse.
- SOBRESATURADAS: Disolución que contiene mayor cantidad de soluto que la permitida a una temperatura determinada. La sobresaturación se produce por enfriamientos rápidos o por descompresiones bruscas. Ejemplo:al sacar el corcho a una botella de refresco gaseoso.
MODO DE EXPRESAR LAS CONCENTRACIONES
Ya sabemos que la concentración de las soluciones es
la cantidad de soluto contenido en una cantidad determinada de solvente o
solución. También debemos aclarar que los términos diluida o concentrada
expresan concentraciones relativas.
EL AGUA Y LAS SOLUCIONES
EL AGUA
El agua es el principal e imprescindible componente del cuerpo humano. El ser humano no puede estar sin beberla más de cinco o seis días sin poner en peligro su vida. El cuerpo humano tiene un 75 % de agua al nacer y cerca del 60 % en la edad adulta. Aproximadamente el 60 % de este agua se encuentra en el interior de las células (agua intracelular). El resto (agua extracelular) es la que circula en la sangre y baña los tejidos.
ESTADOS DEL AGUA
- ESTADO LIQUIDO:
El agua en estado líquido es la que bebemos, la que encontramos en los ríos, en los mares y océanos, en los lagos, en las fuentes, en los acuíferos (aguas subterráneas), la que sale del grifo, etc...
- ESTADO SOLIDO:
El agua en estado liquido, cuando se enfria y llega a los 0º C de temperatura, pasa a estado solido.
El agua en estado solido la encontramos en forma de hielo y nieve en las altas montañas, en el Polo Norte y en el Polo Sur, en el frigorifico en forma de cubitos de hielo, en las tormentas de granizo en forma de bolas de hielo, etc...
- ESTADO GASEOSO:
El agua en estado líquido, al calentarse, se evaporay pasa a estado gaseoso, o sea, se transforma envapor de agua.
Las nubes, la niebla y el rocío son fenómenos meteorológicos que nos hacen visible el vapor de agua que hay en la atmósfera cuando éste se enfría y pasa a estado líquido.
estado sólido.
ESTRUCTURA Y PROPIEDADES DEL AGUA
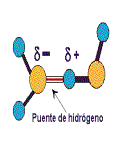
La molécula de agua está formada por dos átomos de H unidos a un átomo de O por medio de dos enlaces covalentes. El ángulo entre los enlaces H-O-H es de 104'5º. El oxígeno es más electronegativo que el hidrógeno y atrae con más fuerza a los electrones de cada enlace.
El resultado es que la molécula de agua aunque tiene una carga total neutra (igual número de protones que de electrones ), presenta una distribución asimétrica de sus electrones, lo que la convierte en una molécula polar, alrededor del oxígeno se concentra una densidad de carga negativa , mientras que los núcleos de hidrógeno quedan parcialmente desprovistos de sus electrones y manifiestan, por tanto, una densidad de carga positiva.
.gif) |
 |
Por ello se dan interacciones dipolo-dipolo entre las propias moléculas de agua, formándose enlaces por puentes de hidrógeno, la carga parcial negativa del oxígeno de una molécula ejerce atracción electrostática sobre las cargas parciales positivas de los átomos de hidrógeno de otras moléculas adyacentes.
Aunque son uniones débiles, el hecho de que alrededor de cada molécula de agua se dispongan otras cuatro molécula unidas por puentes de hidrógeno permite que se forme en el agua (líquida o sólida) una estructura de tipo reticular, responsable en gran parte de su comportamiento anómalo y de la peculiaridad de sus propiedades fisicoquímicas.
Las propiedades físicas
de las sustancias puras dependen de dos factores:
1. De la naturaleza de sus unidades
estructurales (átomos, iones o moléculas).
2. De la intensidad de las fuerzas
(interatómicas, interiónicas o intermoleculares) que existen entre sus unidades
estructurales.
PROPIEDADES FÍSICAS DEL
AGUA:
El agua es el líquido que más sustancias disuelve, por eso decimos que es el disolvente universal. Esta propiedad, tal vez la más importante para la vida, se debe a su capacidad para formar puentes de hidrógeno.
La capacidad disolvente es la responsable de que sea el
- ACCION DISOLVENTE:
El agua es el líquido que más sustancias disuelve, por eso decimos que es el disolvente universal. Esta propiedad, tal vez la más importante para la vida, se debe a su capacidad para formar puentes de hidrógeno.
En el caso de las disoluciones iónicas los iones de las sales son atraídos por los dipolos del agua, quedando "atrapados" y recubiertos de moléculas de agua en forma de iones hidratados o solvatados.
 |
La capacidad disolvente es la responsable de que sea el medio donde ocurren las reacciones del metabolismo.
- ELEVADA FUERZA DE COHESION:
Los puentes de hidrógeno mantienen las moléculas de agua fuertemente unidas, formando una estructura compacta que la convierte en un líquido casi incompresible. Al no poder comprimirse puede funcionar en algunos animales como un esqueleto hidrostático.
- GRAN CALOR ESPECIFICO:
También esta propiedad está en relación con los puentes de hidrógeno que se forman entre las moléculas de agua. El agua puede absorber grandes cantidades de "calor" que utiliza para romper los puentes de hidrógeno por lo que la temperatura se eleva muy lentamente. Esto permite que el citoplasma acuoso sirva de protección ante los cambios de temperatura. Así se mantiene la temperatura constante .
- ELEVADO CALOR DE VAPORIZACION:
Sirve el mismo razonamiento, también los puentes de hidrógeno son los responsables de esta propiedad. Para evaporar el agua , primero hay que romper los puentes y posteriormente dotar a las moléculas de agua de la suficiente energía cinética para pasar de la fase líquida a la gaseosa.Para evaporar un gramo de agua se precisan 540 calorías, a una temperatura de 20º C y presión de 1 atmósfera.
- Reacciona con algunos óxidos
ácidos formando oxácidos.
- Reacciona con alguno óxidos
básicos formando hidróxidos.
- Reacciona con ciertos metales
(metales alcalinos) formando hidróxidos y liberando hidrógeno.
- El agua reacciona con los no
metales, sobre todo con los halógenos, por ej: Haciendo pasar carbón al
rojo sobre el agua se descompone y se forma una mezcla de monóxido de
carbono e hidrógeno (gas de agua).
- Algunos metales descomponen el
agua en frío y otros lo hacían a temperatura elevada.
- El agua forma combinaciones complejas con algunas sales, denominándose hidratos. En algunos casos los hidratos pierden agua de cristalización cambiando de aspecto, y se dice que son eflorescentes, como le sucede al sulfato cúprico (CuSO4.5H2O), que cuando está hidratado es de color azul, pero por pérdida de agua se transforma en sulfato cúprico anhidro de color blanco.
IONIZACION DEL AGUA
 |
El agua pura tiene la capacidad de disociarse en iones, por lo que en realidad se puede considerar una mezcla de :
 agua molecular (H2O )
agua molecular (H2O )
 protones hidratados (H3O+ ) e
protones hidratados (H3O+ ) e
 iones hidroxilo (OH-)
iones hidroxilo (OH-)
En realidad esta disociación es muy débil en el agua pura, y así el producto iónico del aguaa 25º es:
 |
Este producto iónico es constante. Como en el agua pura la concentración de hidrogeniones y de hidroxilos es la misma, significa que la concentración de hidrogeniones es de 1 x 10 -7. Para simplificar los cálculos Sörensen ideó expresar dichas concentraciones utilizando logaritmos, y así definió el pH como el logaritmo decimal cambiado de signo de la concentración de hidrogeniones.
Según esto:
En la figura se señala el pH de algunas soluciones. En general hay que decir que la vida se desarrolla a valores de pH próximos a la neutralidad.
Los organismos vivos no soportan variaciones del pH mayores de unas décimas de unidad y por eso han desarrollado a lo largo de la evolución sistemas de tampón o buffer, que mantienen el pH constante . Los sistemas tampón consisten en un par ácido-base conjugada que actúan como dador y aceptor de protones respectivamente.
El tampón bicarbonato es común en los líquidos intercelulares, mantiene el pH en valores próximos a 7,4, gracias al equilibrio entre el ión bicarbonato y el ácido carbónico, que a su vez se disocia en dióxido de carbono y agua:
 |
Si aumenta la concentración de hidrogeniones en el medio por cualquier proceso químico, el equilibrio se desplaza a la derecha y se elimina al exterior el exceso de CO2 producido. Si por el contrario disminuye la concentración de hidrogeniones del medio, el equilibrio se desplaza a la izquierda, para lo cual se toma CO2 del medio exterior.
Suscribirse a:
Comentarios (Atom)